Un comparaison des reproductions sexuée et asexuée: comparaison reproduction sexuée et asexuée
Les reproductions sexuée et asexuée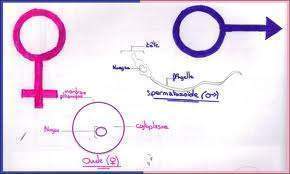
La reproduction asexuée présente diverses modalités. Chez tous les unicellulaires, c’est un processus en apparence simple. Elle se résume à une mitose transversale comme chez la Paramécie, ou à une mitose longitudinale comme chez le Trypanosome ou encore à un bourgeonnement comme chez les Acinétiens. Si l’on s’intéresse à présent aux êtres pluricellulaires, cette reproduction se déroule selon des modalités plus ou moins complexes. Chez les végétaux Angiospermes dans le cas du bouturage, un fragment de tige peut reconstituer un individu complet. Ce phénomène est bien connu chez le rosier où la partie inférieure d’une tige sectionnée donne des racines pendant que des bourgeons apparaissent sur la partie supérieure. Par contre, les bulbilles de la Ficaire (Ficaria ranunculoïdes) ou les tubercules de la Pomme de terre (Solanum tuberosum) montrent que la reproduction asexuée peut se réaliser par l’intermédiaire d’organes spécialisés et atteindre ainsi un certain niveau de complexité. Chez les animaux, elle est limitée aux taxons dont l’organisation est la moins complexe. C’est ainsi qu’elle est absente chez les Mollusques, les Arthropodes, les Vertébrés alors quelle est fréquente chez les Cnidaires, les Spongiaires, les Plathelminthes, les Annélides. On trouvera des exemples détaillés dans tout bon ouvrage de zoologie.
La reproduction asexuée est un processus rapide : elle permet la production d’un nombre supérieur de descendants par rapport à la reproduction sexuée et une vitesse de prolifération élevée. Les raisons en sont bien connues :
- elle ne nécessite généralement pas la construction de structures particulières comme celles qu’exige la reproduction sexuée pour la rencontre des gamètes ou la dissémination ;
- l’individu n’a pas de partenaire, il n’a pas à rechercher un individu de l’autre sexe ou à attendre une éventuelle pollinisation ;
- tous les individus donnent des descendants et pas les seules femelles ;
- elle demande un investissement énergétique plus faible que la reproduction sexuée et cette énergie peut être intégralement investie dans la confection de descendants qui seront ainsi en plus grand nombre. C’est ce que certains chercheurs comme Williams (1975) ou Maynard-Smith (1978) appellent le «coût de la méiose » ou « le coût de la production des mâles ».
Par cette rapidité, la reproduction asexuée permet l’occupation d’un milieu favorable, c’est-à-dire la colonisation. La reproduction asexuée permet aux individus qui y recourent de s’installer sur un milieu tant qu’il est favorable, de pouvoir s’y reproduire et de multiplier ainsi les copies des gènes qu’ils portent. Ceci assure la perpétuation de ces gènes et diminue leur probabilité d’extinction. C’est donc un avantage sélectif pour les gènes .
Ensuite, la reproduction asexuée permet à chaque individu de s’approprier rapidement des ressources indispensables à sa reproduction, et donc à la multiplication de ses gènes, avant d’éventuels compétiteurs. Ces compétiteurs sont en général les autres individus de la même espèce, qui utilisent les mêmes ressources. La reproduction asexuée confère donc un avantage sélectif dans la compétition intraspécifique. En revanche, l’identité génétique supposée des descendants et des parents est seulement une conséquence du mécanisme commun à tous les processus de reproduction asexuée, la division cellulaire par mitose. De plus, on ne peut lui attribuer aucun avantage sélectif. En effet, quand des paramécies s’installent dans une vasque d’eau croupissante, ou quand des renoncules des glaciers colonisent un éboulis grâce à leurs stolons, tous les individus possèdent les capacités pour survivre dans ces milieux. S’ils recouraient à la reproduction sexuée, il est peu probable que le brassage génétique qui en découle¬rait diminuerait réellement cette aptitude à tirer parti du milieu à coloniser. Et de toute manière, cette probabilité est sans doute voisine de celle de voir apparaître des mutants parmi les colonisateurs par voie asexuée.
On peut noter que chez les groupes où l’organisation des individus est complexe et où n’existe pas (en conséquence ?) de reproduction asexuée, un mode de reproduction présentant les mêmes avantages en terme de rapidité existe. Il s’agit de la parthénogenèse où un gamète femelle donne naissance à un nouvel individu sans fécondation. Ce mode de reproduction se rencontre chez les lézards, il est fréquent chez les poissons téléostéens, les crustacés, il est classique chez le puceron où il coexiste avec la reproduction sexuée ou chez les phasmes où il n’existe qu’un mâle pour environ mille femelles. La parthénogenèse des hyménoptères sociaux constitue cependant un cas à part. On se reportera au chapitre 3 pour un développement sur ce sujet.
On a tendance à considérer que la reproduction asexuée, basée sur le phénomène de mitose, donne des individus génétiquement identiques et identiques à leurs parents. Mais une division cellulaire par mitose donne deux cellules identiques aux mutations près. Il existe donc une variabilité au sein des populations se reproduisant par voie asexuée . Cette variabilité est à la base du polymorphisme et les phénomènes de sexualité ne feront que l’amplifier. On ne peut donc pas opposer une reproduction asexuée dite conforme et ne permettant pas à ce titre de variabilité et une reproduction sexuée purement « innovatrice ». L’opposition n’est valable que pour une petite population et pour une courte durée, mais cette affirmation est fausse à l’échelle évolutive. Comme une mutation qui s’exprime donne en général un allèle désavantageux par perte de fonction, l’accumulation de mutations aléatoires sur le génome au cours de la reproduction asexuée dans une population doit donc avoir pour conséquence sa disparition, car rapidement tous les individus seront mutés sur au moins un locus. Et c’est là que la sexualité interviendrait pour réparer l’ADN, et pas seulement pour amplifier une variabilité qui existe déjà.
La sexualité est souvent génétiquement très conservatrice. Nous avons vu que chez une espèce sans reproduction sexuée, et donc sans recombinaison, un gène muté ne peut revenir à son état initial que par mutation reverse de probabilité faible. Par contre, chez une espèce sexuée, si deux chromosomes sont mutés sur des loci différents, le processus de recombinaison permet de restaurer le chromosome ancestral tout en produisant un chromosome doublement muté. Ce dernier pourra être éventuellement éliminé. Les phénomènes de recombinaison intrachromosomique lors de la prophase de la première division de la méiose, constituent donc un mécanisme de réparation de F ADN à l’échelle cellulaire. Ils permettent d’éliminer au sein des populations les mutations délétères qui s’accumuleraient si n’intervenaient que des phénomènes de reproduction asexuée. En ce sens, la reproduction sexuée est un phénomène conservateur de l’information génétique et elle s’oppose à une reproduction asexuée qui au contraire fait apparaître de la variabilité !
Pour certains chercheurs, il n’est pas impossible que la méiose soit primitivement apparue en tant que processus réparateur et qu’elle ait précédé les phénomènes de sexualité. Au début de l’évolution de la vie, les rayonnements qui atteignaient la terre altéraient probablement l’ADN alors que les mécanismes de réparation (enzymes) actuellement connus n’existaient pas encore et la réplication était moins fidèle qu’aujourd’hui. L’apparition des échanges de matériel génétique par recombinaison a apporté une solution en permettant de corriger ces erreurs. Mais des fragments d’ADN étranger, opportunistes, pouvaient s’insérer dans le génome au cours de ce processus, ce qui est peut-être l’origine des virus. Par la suite, les cellules se seraient protégées grâce aux enzymes de restriction chez les Bactéries qui hydrolysent l’ADN étranger et par la création du noyau chez les Eucaryotes. Ces innovations isolaient les gènes d’une éventuelle pollution extérieure.
La méiose, comme les transferts de gènes lors de la recombinaison des bactéries, apparaît donc comme un compromis entre une nécessaire réparation de l’ADN, qui demande une molécule modèle non mutée, et la protection vis à vis d’éléments génétiques étrangers. La rencontre d’un partenaire sexuel de la même espèce, en fournissant une copie très
ressemblante de l’ADN, permet de trier le matériel génétique intervenant dans cette réparation de telle manière que ne soit pas détruit l’ensemble de gènes coadaptés caractéristique de l’espèce. Comme cet ensemble de gènes permet l’utilisation d’une niche écologique particulière elle aussi caractéristique de l’espèce, l’isolement reproducteur maintient l’adaptation de cet ensemble à son milieu, et ainsi l’existence même de l’espèce au travers de la survie des individus.
Les travaux de Taddéi et al (1996) confortent cette approche, car ils apportent d’intéressants arguments à cette vision de la sexualité en tant que mécanisme réparateur. En effet, les auteurs montrent que, chez les bactéries, la barrière entre « espèces » disparaît suite à une mutation des gènes qui interviennent dans la réparation de l’ADN. Autrement dit, si ces cellules possèdent un mécanisme efficace de réparation de leur matériel génétique, elles recourent moins aux phénomènes de sexualité ou avec plus de « discernement ».
On peut donc à présent raconter différemment le cycle des pucerons ou celui des paramécies. L’analyse classique consiste à dire que la reproduction asexuée (ou la parthénogenèse qui a la même signification) qui se produit quand les conditions sont favorables donne des individus identiques entre eux et à leurs parents. La reproduction sexuée qui survient quand les conditions se dégradent va permettre un indispensable brassage de gènes. Un raisonnement faux peut parfois être rencontré dans certains ouvrages. Il consiste à dire que chez de nombreuses espèces la reproduction asexuée ou la parthénogenèse interviennent quand les conditions sont favorables et que la reproduction sexuée correspond à une dégradation des conditions de milieu. Jusque là il s’agit d’une observation non contestable de ce que l’on observe chez les pucerons, la paramécie et fréquemment chez les végétaux par exemple. Malheureusement, la concordance entre sexualité et période défavorable se voit parfois conférer une valeur adaptative, comme si le brassage de gènes permettait à l’espèce de s’adapter à ces conditions défavorables. Là, le raisonnement est faux car il s’agit de conditions défavorables saisonnières ou au moins cycliques auxquelles l’espèce est bien entendu déjà adaptée. De plus, les nombreux cycles mitotiques survenus pendant la saison favorable, où seules comptent la prolifération et l’occupation maximale du milieu, ont accumulé de nombreuses mutations au sein des différents clones. À la lumière de ce qui précède, on peut interpréter l’alternance des deux reproductions d’une autre façon. Lors de la reproduction asexuée, des mutations s’accumulent au sein de la population et elles sont dans presque tous les cas défavorables. La sexualité grâce à la méiose réparatrice de l’ADN va permettre de les éliminer. C’est alors la reproduction asexuée qui crée une variabilité désordonnée et la méiose qui permet de l’éliminer. La sexualité diminue donc la variabilité génétique. L’alternance reproduction asexuée / reproduction sexuée peut donc apparaître comme une sorte de réparation périodique du génome. La recombinaison nécessitant des cellules indifférenciées, la sélection naturelle a vraisemblablement joué pour retenir ce stade comme phase d’enkystement ou de vie ralentie permettant la résistance aux conditions défavorables. D’où cette superposition observée des phénomènes de sexualité et de diapause ou dormance.
Cette approche peut surprendre mais l’article de Taddéi et al. (1996) propose des données qui permettent de tester ce modèle. En effet, pour ces auteurs, le polymorphisme ne dépasse pas 0,1 à 0,5 % chez des espèces sexuées (espèce humaine et certaines espèces de rotifères) alors qu’il atteint 10 % chez les espèces asexuées de rotifères. Autres données qui vont dans le même sens, chez les primates, Eyre-Walker & Keightley (1999) montrent que les mutations délétères s’accumulent au taux théorique de 3 par individu et par génération. Une telle accumulation est impossible car incompatible avec la survie de ces espèces. À moins que la sexualité, comme le suggère Crow (1999), en regroupant les allèles délétères sur les mêmes chromosomes, ne favorise leur élimination et soit ainsi un mécanisme réparateur de l’ADN. Une autre hypothèse serait que ces mutations ne s’expriment pas à cause de protéines chaperons. Rutherford & Lindquist (1998) ont ainsi montré chez la drosophile que si la protéine chaperon Hsp90 subit une mutation, un certain nombre de mutations présentes dans le génome s’expriment toutes en même temps, ce qui montre qu’elles étaient jusque là
masquées. D’autre part, une étude menée sur la levure de bière Saccharomyces cerevisiae par Zeyl & Bell (1997) arrive à une conclusion similaire à celle de Crow. Ces chercheurs ont comparé une population sexuée de ce champignon unicellulaire avec une population asexuée. Ils ont montré que le sexe augmente la valeur sélective des populations sexuées dans des environnements stables auxquels elles sont déjà adaptées mais n’accélère pas leur adaptation à des environnements nouveaux. Ils en ont conclu que l’avantage sélectif apporté par le sexe réside davantage dans le fait qu’il favorise l’élimination des mutations délétères que dans sa capacité à associer des mutations adaptatives dans un même génotype recombiné. Cependant, à côté de ces études qui accréditent l’idée que l’avantage sélectif de la sexualité est l’élimination des mutations, une étude menée sur le bactériophage T4 a montré qu’un taux élevé de recombinaison accélère la résistance à la proflavine (Malmberg 1977) et une étude menée sur la drosophile a prouvé que la suppression des crossing-over ralentit la réponse à une sélection artificielle (Mac Phee & Robertson 1970).
On peut également s’interroger sur l’importance accordée au polymorphisme pour la survie des espèces par certains ouvrages, en particulier scolaires. On a tendance à penser qu’il existe une taille critique en dessous de laquelle une population n’est plus viable et s’éteint par manque de diversité génétique. Une règle avait ainsi été proposée selon laquelle il faut au moins 50 individus pour éviter la dépression consanguine et au moins 500 pour que la diversité génétique soit suffisante pour s’adapter à des changements du milieu. On cite souvent l’exemple du Guépard Acinonyx jubatus qui est quasiment homozygote pour la plupart des loci (O’Brien et al. 1983) et qui s’avère être une espèce menacée de disparition. Pour certains auteurs les deux sont liés. Mis à part que le Guépard n’est pas le seul félidé en péril d’extinction, on connaît des populations dont la diversité génétique est faible et qui sont loin d’être menacées. Ainsi la Bemache du Canada (Branta canadensis), un oiseau de la famille des Anatidés (oies et canards), a été introduite en Europe dans les années 1930. La population suédoise compte 30 000 à 50 000 individus, tous issus de 5 oiseaux fondateurs. Les individus ont pratiquement tous la même empreinte génétique et pourtant cette espèce ne présente aucun signe de dégénérescence et elle est actuellement en expansion en Europe. La population britannique augmente de 8,5% par an et on admet que pour la maintenir à un niveau supportable pour les cultures il faudrait, en plus des animaux tués à la chasse, en détruire 2 000 autres sur les lieux de mue (Roux in Yeatman-Berthelot & Jarry 1994). Autre exemple, les populations européennes de Gypaète barbu (Gypaetus barbatus), un grand rapace mangeur d’os, sont fractionnées en petites unités. Trois populations isolées les unes des autres survivent en Corse (10 couples), dans les Pyrénées (70 à 80 couples) et en Crète (15 couples). On peut supposer que les flux géniques entre elles sont réduits voire nuls et qu’elles connaissent une consanguinité élevée vu leurs faibles effectifs. Pourtant, après une baisse due aux persécutions humaines, la population pyrénéenne est actuellement en expansion (+50% en Espagne entre 1986 et 1994, S.E.O./Birdlife 1997). Celle de Corse est stable depuis de nombreuses années (Terrasse in Yeatman-Berthelot & Jarry 1994). Il convient donc de se méfier des démonstrations trop rapides. En particulier, les environnements dans lesquels vivent les espèces actuelles sont peut-être trop stables pour qu’une faible diversité génétique constitue un réel désavantage adaptatif. Pour finir sur cet aspect de la question, on peut noter que de nombreux ouvrages, pour démontrer l’existence du brassage génétique, s’appuient sur les travaux de Mendel. Ils transposent alors ces résultats à l’échelle évolutive pour expliquer que le brassage génétique par la reproduction sexuée est indispensable à l’évolution des espèces et même simplement à leur survie. Il est amusant de noter que Mendel n’a pu mener ses travaux à bien que parce qu’il possédait des races pures, c’est-à-dire homozygotes pour les loci qu’il étudiait, caractère dû à une autofécondation systématique chez ses petits pois et donc à un brassage génétique inexistant !
Que retenir de cette analyse ?
- A l’échelle évolutive, rien ne prouve que l’association de mutations favorables dans un même génotype recombiné, ce qui augmente le polymorphisme, est l’aspect le plus
important de la reproduction sexuée. Beaucoup de chercheurs conçoivent plutôt la méiose comme un mécanisme réparateur de l’ADN qui diminue donc la variabilité génétique.
- L’importance de la reproduction asexuée réside dans sa rapidité. C’est un problème de compétition intraspécifique. On ne peut pas attribuer de valeur sélective convaincante à l’identité génétique, même quand elle existe réellement.
- Il serait intéressant de disposer d’autres mesures de variabilité ou de valeurs sélectives comparées entre des populations de la même espèce (ou d’espèces du même genre), l’une recourant à la reproduction sexuée et l’autre à la reproduction asexuée.
- Il faudrait de même obtenir des données concernant le nombre de divisions cellulaires, modulé par la quantité d’ADN à répliquer, qui sépare deux épisodes méiotiques dans différentes espèces. Si on trouve une valeur constante entre les groupes, l’idée d’une méiose réparatrice serait confortée. D’ailleurs la mise à l’écart des cellules germinales ou les méristèmes d’attente ne constituent-ils pas des moyens permettant de diminuer l’impact des mutations en limitant le nombre de divisions subies par ces cellules ?
Cependant le problème du maintien de la reproduction sexuée se pose. En effet, les avantages sélectifs que nous avons développés pour justifier son existence sont des avantages à long terme. A court terme par contre, c’est un processus énergétiquement coûteux alors que la reproduction asexuée permet une multiplication rapide et s’avère ainsi beaucoup plus intéressante en terme de valeur sélective (n’oublions pas que la valeur sélective est mesurée par la contribution génétique de l’individu à la génération suivante). On peut présenter le problème autrement . Le sexe est souvent génétiquement fixé chez nombre d’êtres vivants. Les gènes déterminant le sexe femelle confèrent à l’individu porteur des qualités certaines dans l’aptitude à la reproduction (accumulation de réserves, structures protectrice et de dissémination). Or, au cours de la méiose ces gènes sont « dilués » par réduction de moitié puis associés à des gènes mâles. Par mitose simple, ces gènes femelles auraient donc pu se reproduire deux fois plus vite. Pourquoi donc s’encombrer de mâles qui ralentissent ainsi d’un facteur deux la vitesse de multiplication des gènes femelles ? Les modèles montrent que, dans une espèce comme la notre, des formes sexuées devraient être éliminées en une dizaine de générations par des formes asexuées (Gouyon et al 1993). Un certain nombre d’hypothèses ont été avancées pour expliquer le maintien de la sexualité. Chez les plantes on a avancé la construction de structures de résistance et de dispersion (spores, graines, fruits) que l’on ne rencontre que dans la voie sexuée. Chez le puceron, Dedryver et Pierre (I.N.R.A. de Rennes) ont montré que, lors d’hiver doux, les lignées parthénogénétiques envahissent le milieu ce qui suggère que la reproduction sexuée n’est conservée à court terme que par la forme de résistance au froid que constitue l’œuf. Cette approche est difficile à généraliser car elle implique des causes de maintien du sexe pouvant être particulières à chaque espèce. Mais ces causes sont indépendantes de la notion de brassage génétique. Autrement dit, la reproduction sexuée, indispensable à long terme d’un point de vue génétique, n’aurait été conservée que dans les groupes où elle présente un avantage à court terme qui n’a rien de génétique. Mais tout ceci reste à bien des égards spéculatif.
Nous pouvons noter pour finir que certains taxons pratiquent l’auto fécondation systématique. C’est le cas des plantes cléistogames comme les violettes ou du Ténia (Taenia solum) qui sécrète des toxines empêchant tout autre ténia de s’implanter dans l’intestin de son hôte. Les anneaux commencent donc par être de sexe mâle puis deviennent femelles. À ce stade, les gamètes femelles qu’ils contiennent sont fécondés par les spermatozoïdes des anneaux plus jeunes. Les œufs sont évacués par les excréments quand les anneaux vieillissants se détachent. Deux chercheurs de l’université Montpellier II (P. Jame et B. Delay) ont découvert récemment que chez Bulinus truncatus, gastéropode tropical vecteur de la bilharziose, une part non négligeable des individus n’a pas de pénis. Ils ont donc recours à l’auto fécondation systématique et donnent naissance à des individus sans pénis qui font de même. Les éléments génétiques mobiles, qui permettent la résistance du trypanosome aux défenses immunitaires de ses hôtes (Donelson & Tumer 1985), et les mécanismes deréparation de l’ADN dont parle Taddéi et al. (1996) suffisent peut-être chez eux à maintenir l’intégrité du génome en l’absence d’une méiose réparatrice.
Dans le désert américain on trouve une espèce de lézard du genre Cnemidophorus qui se reproduit seulement par parthénogenèse (Cole 1984). Elle semble résulter de l’hybridation de deux autres espèces vivant respectivement dans le désert et dans les prairies. L’hybride parthénogénétique vit à la limite entre ces deux milieux profitant sans doute des adaptations des deux espèces mères. La parthénogenèse semble ici le seul mode de reproduction ayant permis la perpétuation de ces hybrides mais il n’y a chez ces populations ni brassage génétique ni réparation de l’ADN. Autre fait troublant, on sait depuis peu que le développement d’œufs parthénogénétiques peut être provoqué par une piqûre spermatique. C’est le cas chez Poecilia formosa, petit poisson d’Amazonie, pour lequel l’œuf, non seulement se développe après une pseudo fécondation par un mâle d’une espèce apparentée, mais également incorpore des microchromosomes provenant de ces spermatozoïdes déclencheurs (Schartl et al 1995). Quelle est la signification évolutive de ces mécanismes ? Où placer la limite entre espèces ? Autant de questions pour l’instant sans réponses satisfaisantes si ce n’est que l’on peut envisager là encore une sorte de recombinaison permettant de diminuer le poids de la mutation.
Il est donc difficile d’apporter une réponse simple à la question de l’existence du sexe. Comme l’écrivait Maynard Smith : « on a l’impression que quelque chose de fondamental nous échappe à ce sujet (la sexualité) ». Mais peut-être pourrions nous finir en citant E. Morin : «le vrai problème n’est […] pas de ramener la complication à des règles de base simples. La complexité est à la base […]. Le simple n’est qu’un moment arbitraire d’abstraction arraché aux complexités… »
La complexité est à la base […]. Le simple n’est qu’un moment arbitraire d’abstraction arraché aux complexités… »
Vidéo: Un comparaison des reproductions sexuée et asexuée
Vidéo démonstrative pour tout savoir sur: Un comparaison des reproductions sexuée et asexuée