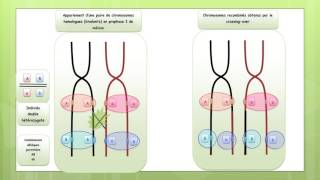
Les conséquences du crossing-over inégal
Meiosis: Crossing Over
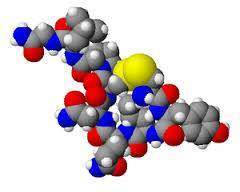
L’exemple des hormones de la neurohypophyse des Vertébrés (Fontaine 1984) va nous permettre d’illustrer cette importante fonction évolutive du crossing-over et donc de la sexualité. Chez les Mammifères, la neurohypophyse sécrète deux hormones qui sont des polypeptides ayant le même nombre d’acides aminés, 9, et qui ne diffèrent que par deux d’entre eux. Ces deux hormones sont la vasopressine et l’ocytocine. La vasopressine stimule la réabsorption d’eau au niveau du rein et contrôle la contraction des muscles lisses des artérioles d’où un effet sur la pression artérielle. L’ocytocine provoque la contraction des muscles lisses de l’utérus et stimule l’éjection de lait de la glande mammaire. Chez les Vertébrés les plus anciens comme les Agnathes on ne connaît qu’une hormone : la vasotocine qui a, elle aussi, 9 acides aminés. Elle a un rôle de contrôle de la circulation sanguine. Chez les Poissons cartilagineux on trouve à côté de cette hormone une nouvelle hormone de 9 acides aminés qui peut être l’ocytocine, la glumitocyne ou la valitocyne. Ces deux hormones ont une nouvelle fonction en plus de contrôler la circulation sanguine : elles stimulent les parois de l’oviducte mais c’est la vasotocine qui reste la plus active dans cette fonction. Chez les Dipneustes, les Amphibiens et les Reptiles on trouve une nouvelle hormone en plus de la vasotocine et de l’ocytocine : c’est la mésotocine. Cette hormone a un rôle de récupération d’eau au niveau des épithéliums (peau, tubules rénaux, vessie). Cependant cette fonction est également réalisée par la vasotocine.
On peut donc penser que ces différentes hormones ont une origine commune. L’hormone ancestrale est la vasotocine qui est seule présente chez le groupe paléontologiquement le plus ancien (Agnathes). Le gène codant pour cette hormone s’est ensuite dupliqué, c’est-à- dire qu’une deuxième copie est apparue. La copie surnuméraire a alors muté mais sans perte de fonction pour l’organisme car une copie fonctionnelle existe toujours. Les hormones ainsi apparues ont acquis des fonctions propres et on aboutit chez les Mammifères à une hormone à fonction ionorégulatrice (la vasopressine) et une hormone à fonction reproductrice (l’ocytocine). La lenteur de différenciation des deux fonctions au cours de l’évolution est supposée refléter le temps nécessaire à l’apparition de récepteurs spécifiques, l’hormone apparais¬sant avant que n’existe pour elle des cibles privilégiées. Deux mécanismes sont proposés pour la duplication des gènes. Le plus classique est le crossing-over inégal au coursduquel les échanges de matériel génétique entre les chromosomes homologues appariés ne sont pas symétriques. Un des deux chromosomes perd une certaine quantité d’ADN qui est gagnée par l’autre. Si l’échange inégal concerne un gène entier, un des deux chromosomes le possède en deux copies associées en tandem alors que l’autre le perd. Un autre modèle de duplication fait intervenir les transpositions (voir chapitre 2.II.), sans phénomène de crossing-over. Lorsqu’un élément génétique mobile se déplace au sein du génome, il peut d’abord y avoir réplication de l’ADN correspondant (Alberts et al 1994). Deux copies du gène vont alors exister dans la cellule mais sur des sites qui pourront être éloignés.
Des exemples similaires d’apparition de protéines par duplication de gènes peuvent être donnés pour les hormones gonadotropes hypophysaires (FSH. LH) et pour l’hormone thyréotrope (TSH) des Vertébrés supérieurs dont les gènes respectifs dériveraient d’un même gène ancestral présent chez les Agnathes (Fontaine 1984). Un modèle d’évolution par duplication de gènes peut également être proposé pour les hémoglobines humaines (Ruffié 1983, Hélène 1985, Watson 1994). Trois types d’hémoglobine (plus la myoglobine) existent chez l’homme qui résultent de l’association deux à deux de quatre chaînes polypeptidiques, oc, (3, y, 8 ou 8. Les gènes correspondants sont successivement activés et inactivés ce qui fait que différentes hémoglobines se succèdent dans le sang. Une hémoglobine embryonnaire est remplacée par une forme fœtale au cours de la gestation. La forme adulte apparaît un peu avant la naissance et remplace totalement la forme embryonnaire vers l’âge de six mois. L’avantage de la forme fœtale pour l’embryon est que son affinité pour l’oxygène est supérieure à celle de l’hémoglobine adulte. Il y a donc transfert de l’oxygène de la mère au fœtus. Chez l’homme, le locus de l’aglobine, situé sur le chromosome 16, comporte le gène de la forme embryonnaire et ceux des formes fœtale et adulte. Le locus de la pglobine, situé sur le chromosome 11, comporte le gène de la forme embryonnaire, et ceux des formes fœtale et adulte . La similitude de l’organisation et de la séquence de ces gènes suggère là aussi qu’ils sont apparus au cours de l’évolution par duplication d’un gène ancestral. Au voisinage de ces gènes se trouvent des pseudogènes de séquences voisines mais non fonctionnels. Ils diffèrent des gènes fonctionnels par de nombreuses mutations. Ceux du chromosome 16 ont par exemple 73% d’homologie de séquence avec les gènes de l’a-globine (Watson 1994). Ces pseudogènes, n’étant soumis à aucune pression de sélection, sont le siège de nombreuses mutations. Ils dériveraient de gènes actifs suite à un crossingover inégal. Quant au gène de la y-globine, son ARNm est faiblement exprimé et il ne s’agit pas d’une forme essentielle. Il pourrait s’agir d’une forme intermédiaire entre gène fonctionnel et pseudogène.La duplication des gènes illustrée par ces exemples présente un grand intérêt comme mécanisme de l’évolution. Elle permet en effet de comprendre comment de nouveaux gènes peuvent apparaître par mutations d’autres gènes au cours des processus évolutifs sans que ceci ait pour conséquence la disparition de la fonction codée par le gène ancestral. Il y a donc mutation sur ce gène dupliqué en l’absence de sélection. C’est une conséquence directe de la recombinaison intrachromosomique et donc de la sexualité.
La duplication semble également intervenir dans le domaine évolutif en permettant l’apparition de nouveaux gènes à partir de séquences existantes qui sont associés dans la nouvelle protéine. Deux arguments peuvent être avancés à l’appui de cette idée. Tout d’abord, sur l’ensemble des protéines qui ont été séquencées, on n’a déterminé que 7 000 à 10 000 exons différents. Ensuite, si l’on étudie les séquences du récepteur membranaire à la LDL (lipoprotéine de faible densité), on détermine 18 exons mais qui peuvent être regroupés en six catégories définissant des domaines aux fonctions différentes.  Il se trouve que certains de ces groupes d’exons sont homologues de régions d’autres protéines (protéine C9 du complément, récepteur de l’EGF) (Watson et al. 1994). D’où l’idée de leur apparition par duplication. La diversité des protéines serait donc obtenue par association d’un nombre limité de séquences de base. On trouvera un exemple voisin avec la famille des immunoglobulines (Alberts et al 1994).
Il se trouve que certains de ces groupes d’exons sont homologues de régions d’autres protéines (protéine C9 du complément, récepteur de l’EGF) (Watson et al. 1994). D’où l’idée de leur apparition par duplication. La diversité des protéines serait donc obtenue par association d’un nombre limité de séquences de base. On trouvera un exemple voisin avec la famille des immunoglobulines (Alberts et al 1994).
Vidéo: Les conséquences de crossing-over inégal
Vidéo démonstrative pour tout savoir sur: Les concéquences de crossing-over inégal