L'influence de la prédation sur la dynamique des populations : Variations de fréquences géniques chez les prédateurs
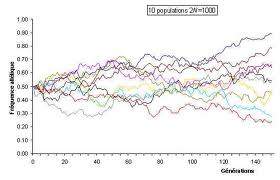 S’il paraît évident que tout prédateur est adapté au type de proies qu’il capture, il n’en demeure pas moins vrai que l’impact de ces proies sur cette adaptation est généralement passé sous silence. Les exemples bien documentés et aisément accessibles sont en effet peu nombreux.
S’il paraît évident que tout prédateur est adapté au type de proies qu’il capture, il n’en demeure pas moins vrai que l’impact de ces proies sur cette adaptation est généralement passé sous silence. Les exemples bien documentés et aisément accessibles sont en effet peu nombreux.
Un premier exemple disponible est celui du Coucou gris européen Cuculus canorus étudié en Grande-Bretagne par Davies et Brooke (1991) (pour une description précise de la biologie de cet oiseau, voir Géroudet 1980).
Pourquoi assimiler cette espèce à un prédateur ? Là encore, on retombe sur une remarque faite plus haut : la valeur sélective des individus auxquels elle s’attaque diminue (pour les couples nicheurs parasités) ou s’annule (pour les descendants, œufs ou poussins, de ces couples). L’impact de cette interaction coucou-hôte, s’apparente donc à l’impact que peut avoir un prédateur sur une population de proies.
Dans cette situation particulière, la pression de sélection exercée sur le coucou est forte, car il s’agit d’un « parasitisme » obligatoire, tous les individus devant passer par cette interaction pour assurer leur reproduction. À quels problèmes le prédateur est-il soumis dans ce système ? Quelles sont les adaptations qu’il développe ?
D’après les auteurs, les femelles coucou doivent d’abord repérer leurs proies potentielles, ensuite déposer leurs œufs dans le nid sans que ceux-ci soient rejetés. Enfin, le développement du poussin doit être compatible avec les possibilités de nourrissage des parents adoptifs avec pour contrainte particulière le fait que la distribution de nourriture doit être ajustée au rythme de croissance du jeune coucou.
L’expérience montre que les petits passereaux sont très vigilants en début de journée et s’absentent plus fréquemment du nid en fin d’après-midi. Ils sont en général capables de reconnaître leurs œufs par la taille et par la couleur. En revanche, ces oiseaux sont incapables de faire la différence entre leurs poussins et ceux d’espèces différentes. Ils reconnaissent comme leur descendant tout poussin sortant d’un œuf présent dans leur nid, ce qui, au plan évolutif, simplifie les processus de reconnaissance. De la même façon, les poussins reconnaissent pour parent le premier être ou objet qu’ils rencontrent après l’éclosion .
En réponse à ces pressions de sélection le coucou présente les adaptations suivantes :
- Tout d’abord la femelle est capable de pondre rapidement afin de profiter de toute absence, même brève, de sa victime. Mais cela contraint l’espèce à limiter son action aux espèces construisant un nid ouvert. De plus ces femelles doivent choisir des « proies » elles- mêmes insectivores.
- Dans tous les cas l’œuf du coucou est deux à trois fois plus petit que les œufs pondus par des oiseaux de taille équivalente, ce qui limite la probabilité de rejet. Dans la majorité des situations, l’œuf pondu mime presque parfaitement ceux de l’espèce cible, ce qui suggère l’existence de lignées de coucou. Sur cinq lignées étudiées en Angleterre, la taille des œufs et l’intensité des taches ponctuant leur coquille ne sont pas significativement différentes d’une lignée à l’autre. En revanche, l’intensité de la couleur de fond de la coquille, mesurée par la réflectance de la surface de cette coquille, est significativement différente d’une lignée de coucou à une autre et elle varie comme l’intensité de la couleur des œufs de leurs hôtes respectifs . De plus, dans le nord du pays, où le Pipit farlouse Anthus pratensis est l’hôte principal, les œufs de coucou « à pipit » sont plus sombres et plus mimétiques que dans le sud, où le pipit est un hôte accessoire (Brooke & Davies 1988). On a donc une relation intéressante entre le mimétisme et l’intensité de la pression de sélection.
Comment se fait la transmission de ce caractère « couleur des œufs » à l’intérieur des différentes lignées ? Il n’y a pas pour l’instant de réponse satisfaisante à cette question. Comment la femelle coucou reconnaît-elle l’espèce « proie » correspondant à sa lignée ? On peut penser qu’elle s’imprégne au cours de son élevage par ses parents adoptifs. Ce mécanisme permettrait de renforcer l’existence de lignées génétiquement différentes dont les caractères seraient transmis par la femelle.
-Enfin, le nourrissage du jeune coucou par ses «parents adoptifs » est le fruit d’une interaction fondée sur le « piratage » des signaux de communication entre poussins et adultes. Chez les espèces nidicoles, le comportement de nourrissage est déclenché et entretenu par des signaux divers. Les deux principaux sont le rythme et l’intensité des cris poussés par les poussins à l’approche des adultes ainsi que l’exposition des larges surfaces vivement colorées qui tapissent l’intérieur de la cavité buccale. Ces deux paramètres augmentent en intensité avec la croissance des jeunes (Kilner et al. 1999). Le problème pour le jeune coucou est que la surface de sa gorge n’augmente pas aussi vite que la surface totale exposée par une nichée moyenne de pipit ou de rousserolle. Dans le couple coucou-rousserolle effarvate, Kilner et ses collaborateurs ont montré que cet inconvénient est compensé par une variation très sensible du paramètre sonore, le rythme et l’intensité des cris du jeune coucou augmentant fortement . Cette forte augmentation impose une contrainte en retour au coucou, dans la mesure où une partie de l’énergie tirée de la nourriture apportée par les parents est ainsi dépensée. Ceci explique peut-être que les coucous n’épuisent pas totalement leurs « proies » en les contraignant à un rythme de nourrissage exténuant, ce que l’on attendrait dans la mesure ou génétiquement les coucous n’ont aucun intérêt à la survie de leur hôtes. On voit ici apparaître encore une fois la notion de compromis adaptatif.
Un deuxième exemple peut être utilisé afin de montrer l’effet de variations de populations de proies sur l’évolution biologique des prédateurs. Les pinsons de Darwin des îles Galapagos sont vraisemblablement issus d’une spéciation par radiation adaptative (Lack 1947, Grant 1986). Les 13 espèces qui peuplent l’archipel sont issues d’un ancêtre commun et ont toutes les mêmes proportions corporelles. Elles se distinguent cependant par leurs tailles (7 à 12 cm) et par la forme et l’épaisseur du bec. Des variations climatiques sévères, liées au phénomène El Nino, modifient la végétation des îles et par conséquent la nourriture disponible. Grant (1991) a étudié l’impact de ces modifications sur les deux populations de pinsons peuplant l’île de la Grande Daphné. Il a ainsi pu montrer qu’à la suite des années de sécheresse l’épaisseur moyenne des becs de ces oiseaux était augmentée et qu’à l’inverse, cette épaisseur était diminuée à la suite d’années pluvieuses.
Avant de déduire quoi que ce soit de ces observations, il faut s’assurer que le caractère « épaisseur du bec » est héritable. C’est ce qui a été fait chez le Pinson à bec moyen, Geospiza fortis . Fort de cette constatation, on peut proposer l’explication suivante.
Lors des années de sécheresse, la flore est profondément remaniée sur ces îles. La biomasse totale est extrêmement réduite et les seules graines disponibles sont grandes et dures . On constate dans le même temps une très forte mortalité des pinsons qui sont essentiellement granivores , et les survivants sont en moyenne significativement plus grands avec un bec plus épais que les individus de la population originelle . Cette dernière estimation est obtenue à l’aide d’une Analyse en Composante Principale réalisée sur 7 paramètres corporels . La composante n°l, la plus discriminante, est fortement corrélée au poids corporel et aux dimensions du bec (Boag & Grant 1981).
On est donc ici en présence d’une sélection « à rebours » dans la mesure où les caractéristiques des populations « proies », ici les graines, déterminent les caractéristiques génétiques de la population de « prédateurs ».
Enfin, pour terminer sur le sujet, on peut citer l’exemple de phénomènes de convergence, qui permettent à des prédateurs ou assimilés de « tromper » leurs proies. Chez certaines espèces de diptères de la famille des Tachinides, les femelles pondent leurs œufs à l’intérieur du corps d’un grillon mâle. Du point de vue de la reproduction, ces mouches sont donc soumises aux mêmes pressions de sélection que les grillons femelles : trouver un mâle, à distance. Elles doivent donc disposer d’un organe auditif susceptible de détecter les hautes fréquences émises par les grillons mâles. Or, chez les diptères les organes « auditifs » antennaires sont plutôt sensibles aux basses fréquences et permettent le repérage à courte distance. Chez les parasitoïdes du genre Ormia dont il est question ici, les individus possèdent un organe auditif sur le mésothorax qui ressemble tout à fait à l’organe tympanique des grillons femelles (Robert et al. 1992). De plus, il y a un dimorphisme sexuel de l’audition, les mâles et les femelles n’ont pas la même sensibilité. Les femelles Ormia ont une très importante acuité auditive pour les fréquences émises avec le plus de puissance par les grillons, ce qui n’est pas le cas des mâles. En revanche, mâles et femelles ont la même acuité pour les fréquences ultra- sonores comprises entre 15 et 50 kHz émises par les chauves-souris, principaux prédateurs de ces mouches actives au crépuscule .  On a donc là une évolution orientée d’un ensemble de caractères liés à la réalisation d’une fonction. L’évolution est en quelque sorte dirigée par la pression de sélection que représente la nécessité de trouver une « proie » pour y pondre ses œufs.
On a donc là une évolution orientée d’un ensemble de caractères liés à la réalisation d’une fonction. L’évolution est en quelque sorte dirigée par la pression de sélection que représente la nécessité de trouver une « proie » pour y pondre ses œufs.