Oxyde d’azote (NO)
Définition d’Oxyde d’azote (NO)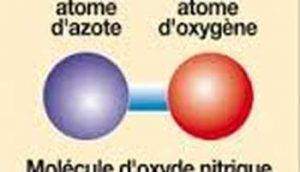
Ce gaz toxique, considéré autrefois comme un polluant atmosphérique, est la clé qui ouvre la valve qui permet au sang d’affluer vers le pénis. Cette molécule active de nombreux autres processus de l’organisme : certains d’entre eux peuvent devenir incontrôlables. Mais comment se forme-t-il, ce radical libre tout simple ? Et comment agit-il ?
L’oxyde d’azote régule les activités de notre corps de la tête aux pieds. Le cerveau, le nez, la gorge, les poumons, l’estomac, le foie, les reins, les organes génitaux, les intestins et les vaisseaux sanguins ont tous besoin de lui. Il est présent lorsque nous avalons et lorsque nous déféquons. On en a besoin dans la lutte contre les virus, les bactéries et les parasites. Il est impliqué dans chaque pensée fugitive, chaque rêve et chaque douleur que nous ressentons. À chaque instant de notre vie, notre organisme génère une réserve constante de molécules NO, chacune d’entre elles ne vivant pas plus de quelques secondes. Certaines situations médicales nécessitent que la réserve en NO soit stimuléeen quelques minutes, alors que pour d’autres, cette réserve doit être immédiatement réduite.
Le cœur a besoin d’oxygène afin de produire l’énergie nécessaire pour pomper le sang qui est amené par les artères coronaires. Si celles- ci sont rétrécies, généralement par des dépôts graisseux, le patient ressent les douleurs thoraciques d’une angine de poitrine, résultant souvent d’un ultime effort de leur part. (Si les artères se bouchent, le patient est alors victime d’une attaque cardiaque.) Les artères ont besoin de fixer rapidement le NO. Certains anciens traitements de l’angine de poitrine sont capables de compléter la réserve de NO présente naturellement dans notre corps et de stimuler ainsi le flux sanguin vers le cœur en relâchant les muscles des vaisseaux sanguins. Chez un homme, la même molécule et le même effet déclencheront une érection par le même processus chimique.
Il semble difficile de comprendre pourquoi notre corps a impérative¬ment besoin de NO car, pendant longtemps, il a été considéré comme un gaz désagréable, qui réagit avec l’oxygène pour donner du dioxyde d’azote (N02) qui réagit à son tour avec l’eau pour former de l’acide nitrique (HN03), un processus qui a contribué autrefois à la pollution atmosphérique et aux pluies acides. L’oxyde d’azote est un radical libre et l’organisme est engagé dans une lutte sans merci contre ces molécules qui peuvent détériorer les cellules, provoquer le vieillissement et déclencher un cancer. Générer délibérément du NO semble improductif, mais nous sommes en présence d’une molécule plutôt exceptionnelle.
L’oxyde d’azote a probablement été synthétisé pour la première fois par Johannes Baptista van Helmont (1579-1644), un alchimiste flamand qui menait une vie de reclus dans sa propriété privée près de Bruxelles. Il était plus qu’un alchimiste en quête de la Pierre Philosophale et de l’Elixir de Jouvence, comme le révélèrent les documents publiés par son fils juste après sa mort.
Van Helmont savait qu’il existait différents gaz, et fut le premier à utiliser ce mot, qui vient du mot grec khaos, « chaos ». Bien qu’il ait probablement synthétisé l’oxyde d’azote, les techniques dont il disposait pour étudier ses propriétés étaient très limitées. Le chimiste anglais Joseph Priestley (1733-1804) qui conçut une méthode de récupération des gaz leur permettant de se dégager à l’intérieur d’un récipient de verre retourné, rempli d’eau. On lui a attribué à juste titre la découverte de NO en 1772, bien que son travail ait pu être inspiré des observations antérieures de l’alchimiste anglais John Mayow (1640-1679), qui évoquait dans ses écrits différents « airs », dont l’un d’entre eux aurait bien pu être NO.
Plusieurs réactions chimiques permettent d’obtenir NO, mais la plus simple, celle que l’on utilise dans les laboratoires des lycées, consiste à faire goutter de l’acide nitrique concentré sur de la tournure de cuivre. Il se forme d’abord des vapeurs rouge-brun dans le récipient de la réaction à mesure que l’oxyde d’azote formé réagit avec l’oxygène piégé de l’air pour former du dioxyde d’azote, mais ce sous-produit non désiré se dissout à mesure que le gaz fait des bulles dans l’eau, et le NO que l’on récupère est incolore. La meilleure façon d’obtenir une petite quantité de NO pur est de faire réagir du nitrite de sodium (NaN02) avec de l’acide ascorbique (vitamine C).
Au contact de l’air, NO vire rapidement au rouge-brun. Cette réaction se produit uniquement au contact de l’air atmosphérique car la vapeur d’eau sert de catalyseur. (L’oxygène gazeux sec ne réagit pas avec NO). Chimiquement, ce gaz se comporte comme l’oxygène, c’est-à-dire qu’il aide à la combustion, mais de manière moins efficace que l’oxygène.
L’oxyde d’azote exerce une certaine fascination sur les chimistes car c’est une espèce rare, un radical libre stable. La présence d’un électron « célibataire » devrait en faire une espèce très réactive, mais cela n’est pas le cas et au fil des ans, le gaz a été largement étudié. Il peut perdre son électron célibataire et se transformer en NO+, l’ion nitrosonium, lequel peut même être produit et manipulé sous forme d’un sel de sulfate. NO+ a une grande capacité à former des liaisons avec des métaux et on connaît des centaines de composés de ce type.
Pour produire NO à l’échelle industrielle, on fait réagir l’ammoniac (NH3) et l’oxygène gazeux à 900 °C, en présence de vapeur d’eau et d’un catalyseur constitué de deux métaux, le platine et le rhodium. Ce gaz a deux utilisations principales : produire de l’acide nitrique en vue de la fabrication d’un engrais, le nitrate d’ammonium (NH4N03) et produire de Fhydroxylamine (NH2OH) pour fabriquer du nylon. Dans le premier cas, il est probable que NO finira dans notre orga¬nisme sous forme de protéine, et dans le second cas, il fera probable¬ment partie de notre environnement, et sera peut-être même collé à nos jambes.
Au XXe siècle, l’oxyde d’azote jouait le rôle indésirable de l’un de ces gaz que l’on nommait NOx, émis par les échappements des moteurs. Il était partiellement responsable du brouillard qui polluait l’air des villes des climats chauds et était également un facteur de contribution aux pluies acides des climats tempérés. Ces deux problèmes sont mainte¬nant placés sous contrôle, le gaz a perdu ses stigmates, et maintenant, lorsque les jeunes entendent parler de NO, ils le connaissent plus probablement pour son rôle clé dans le sexe.
NO, une petite molécule surprenante 
Comment a-t-on découvert le rôle de NO dans notre organisme ? En fait, il constituait le chaînon manquant d’une suite d’événements…
On pensait, autrefois, que l’acétylcholine était la molécule messagère qui ordonnait aux muscles des vaisseaux sanguins de se relâcher. Cependant, lorsque les deux scientifiques américains Robert Furchgott et John Zawadzki enlevèrent les cellules endothéliales qui tapissent les parois des vaisseaux sanguins et qui interagissent avec l’acétylcholine, ils trouvèrent que cette molécule n’avait plus l’effet attendu. De toute évidence, l’acétylcholine était seulement la première messagère, et il en existait une seconde, libérée par les cellules endothéliales, qui agissait sur les muscles. Que pouvait bien être cette seconde messagère ? Ils la nommèrent EDRF, abréviation d’endothelium-derived relaxing factor (facteur de relaxation dérivé de l’endothélium) mais n’en trouvèrent aucune trace.
Le problème en resta là, bien que certaines suggestions aient laissé entendre que l’EDRF ressemblerait aux molécules qui avaient aussi la faculté de relâcher les muscles des vaisseaux sanguins, c’est-à-dire la nitroglycérine et le nitrite d’amyle. Leur point commun est la présence dans leur formule d’un groupement N02 qui, de toute évidence, est lié à leur action médicale.
Finalement, on comprit que la seconde molécule messagère était NO. | Vu la nature de ce gaz, on accepta difficilement cela ; pourtant on savait déjà que ce gaz pouvait être produit et émis par des bactéries.
L’idée que des animaux supérieurs produiraient délibérément ce gaz et l’utiliseraient semblait absurde car NO était un radical libre gazeux, instable et toxique. Sa production par l’organisme semblait improbable, tout autant que l’attribution d’un prix Nobel. Mais l’organisme en produisait, et le Prix Nobel fut au rendez-vous (voir ci-dessous).
Prix Nobel pour « NO »
En 1998, le Prix Nobel de Médecine fut attribué à Robert Furchgott, Ferid Murad et Louis Ignarro « pour leur découverte du fait que l’oxyde d’azote est une molécule signal du système cardio-vasculaire ». Ce travail méritait bien ce prix car les lauréats montraient pour la première fois qu’un gaz pouvait agir de cette façon.
En 1980, Furchgott conçut une expérience prouvant l’existence d’une molécule signal inconnue qui relâche les muscles des vaisseaux sanguins. En 1977, Ferid Murad avait découvert que la nitroglycérine libère NO, qui relâche les muscles lisses. Il pensa, sans pouvoir le prouver, que NO pouvait jouer un rôle naturel dans l’organisme. C’est en 1986 que Louis Ignarro effectua finalement l’analyse qui prouvait que NO était la molécule messagère.
Tandis que les futurs lauréats du Prix Nobel menaient leurs recherches, d’autres scientifiques de l’industrie pharmaceutique s’intéres¬saient au problème. Au milieu des années 1980, Salvador Moncada et ses collègues des laboratoires de recherche Wellcome à Beckenham (Angleterre) reconnurent que NO était le messager manquant : Afin d?en étudier les effets, ils mirent au point un modèle réduit de l’appareil de l’industrie automobile qui mesure la quantité de NO dans les gaz d’échappement.
En utilisant le gaz NO directement à partir d’une bouteille, ils purent montrer comment ce gaz provoquait le relâche¬ment des muscles. À leur grande surprise, ils découvrirent également que les vaisseaux sanguins pouvaient fabriquer le NO nécessaire à partir d’un acide aminé, l’arginine, dont les réserves sont très abondantes dans notre organisme. La protéine des noix est particulièrement riche en arginine et les cacahuètes, par exemple, en contiennent 11 %. Parmi les aliments riches en arginine, on peut citer les petits pois (9 %), le riz (9 %), la viande (7 %), les œufs (6 %), le poisson (6 %) et les pommes de terre (5 %). Notre sang contient environ 14 mg d’arginine par litre.
Le squelette de l’arginine comporte un groupement guanidine et c’est l’un des azotes de cette partie de l’acide aminé qui est arraché pour former NO. La NO synthase est l’enzyme responsable de cette réaction qui nécessite également la présence de gaz oxygène (02) dont l’un des atomes se lie à l’azote pour former NO, alors que l’autre prend la place de l’azote arraché dans F arginine, la transformant alors en catullien. (Notre organisme peut à nouveau la recycler en arginine.) L’un des premiers éléments de preuves montrant que NO provient de cet acide aminé consistait à utiliser de l’arginine marqué comportant un azote– 15 radioactif que l’on retrouvait finalement dans NO et que l’on pouvait détecter par spectrométrie de masse.
La capacité des micro-organismes à produire NO n’est pas un développement évolutif récent, comme en témoigne le limule dont l’origine remonte à 500 millions d’années. Ce fossile vivant élabore un mécanisme de fabrication de NO à partir de l’arginine et utilise NO pour empêcher ses cellules sanguines de coaguler.
Le groupe Wellcome était désormais capable d’expliquer comment fonctionnaient1 le nitrite d’amyle et la nitroglycérine. Ces deux médicaments pouvaient stopper une attaque douloureuse d’angine de poitrine en libérant davantage de NO ; ce dernier permet le relâche-ment des vaisseaux sanguins resserrés qui réduisent l’apport en sang et en oxygène vers le muscle cardiaque. La nitroglycérine qui possède trois groupements nitro, en perd un lorsqu’elle rencontre une enzyme, l’aldéhyde déshydrogénase mitochondriale, qui catalyse la formation de l’ion nitrite NO-2 ce dernier étant facilement réduit en NO. Cependant, la mitochondrie ne peut traiter de cette façon que de faibles quantités de nitroglycérine, ce qui explique pourquoi les effets de ces vasodilatateurs sont si brefs.
L’action précise de la nitroglycérine n’a été mise en lumière qu’en 2002, par les travaux de Jonathan Stamler et de son équipe de la faculté de médecine de Durham en Caroline du Nord (Etats-Unis) : ils ont découvert que la libération de NO de la nitroglycérine avait lieu sous l’action d’une enzyme appelée l’aldéhyde déshydrogénase mitochondriale. Ils ont également pu expliquer pourquoi des doses successives de nitroglycérine agissaient de moins en moins. En effet, chaque enzyme agissant sur une molécule de nitroglycérine est alors désactivée, dans la mesure où elle peut s’en occuper, et il est donc possible de rendre inactives toutes les enzymes dans la mitochondrie.
L’oxyde d’azote a été identifié au niveau du cerveau par John Garthwaite et ses collègues de l’Université de Liverpool, en Angleterre. Ils ont montré que cet organe fabriquait NO de la même façon que les vaisseaux sanguins. Solomon Snyder de l’Université John Hopkins des États-Unis a confirmé leurs résultats en clonant l’enzyme génératrice de NO, la NO-synthase, et en montrant qu’elle était abondante dans le cerveau. En fait, il existe trois sortes de NO-synthéase dans notre organisme : l’une pour les artères, l’autre pour le cerveau, et la troisième pour le système immunitaire. Le fait que le cerveau contienne plus de NO synthase que tout autre organe révèle l’importance de NO pour son fonctionnement.
L’oxyde d’azote pourrait bien être le « messager rétrograde » le plus recherché qui est à la base de la mémoire. Comment une cellule réceptrice de notre cerveau qui a déjà été stimulée une fois, reconnaît- elle à nouveau la même stimulation ? Elle le fait en envoyant en retour « message reçu et compris » à la cellule émettrice qui, à son tour, se programme pour envoyer, la fois suivante, un message plus fort. Vu l’abondance de NO dans le cerveau, les chercheurs ont supposé qu’il servait de messager, bien que l’on n’en ait encore aucune preuve.
NO est une molécule de petite taille qui peut diffuser facilement à l’intérieur et à l’extérieur des cellules ; après avoir joué son rôle, elle disparaît rapidement. NO est générée par les neurones, se répand rapidement et active toutes les cellules situées dans son environnement immédiat. Les leucocytes du sang agissant comme des macrophages, produisent de grandes quantités de NO et l’utilisent comme gaz de combat contre tous les micro-organismes envahissants.
La réponse peut être si forte qu’elle dilate les vaisseaux sanguins jusqu’à provoquer chez le patient une chute de la tension artérielle et une perte de connaissance. Cela pourrait être le premier symptôme indiquant qu’une personne est atteinte d’un choc septique qui peut rapidement être fatal. Pour traiter de tels patients, on utilise des inhibiteurs qui bloquent les enzymes responsables de la production de NO : ces inhibiteurs peuvent normaliser la tension artérielle en quelques minutes. Il est rare de se trouver en présence d’un excès de NO : avec l’âge, on a plutôt tendance à observer un manque de NO qui peut se manifester par une maladie cardiaque ou une angine de poitrine.
L’oxyde d’azote peut diffuser facilement et rapidement à l’intérieur et à l’extérieur des tissus de notre corps mais il ne peut traverser les vaisseaux sanguins, car s’il venait à pénétrer dans un globule rouge, il serait alors rapidement détruit. En effet, il y rencontrerait une molécule d’hémoglobine transportant de l’oxygène qui provoquerait une réaction d’oxydation rapide de NO en nitrite et peut-être même en nitrate.
Intrinsèquement, l’oxyde d’azote peut être considéré comme un radical libre relativement stable, et il l’est effectivement si on le compare à d’autres radicaux libres dont la durée de vie n’est que d’une fraction de seconde. Cependant, sa durée de vie est si courte qu’il est pratiquement impossible de l’observer en action. Des méthodes de détection de NO, à faibles concentrations, ont été mises au point, mais elles n’étaient pas adaptées à son étude in vivo. La situation changea totalement lorsque Tetsuo Nagano et ses collègues du groupe de chimie analytique de l’École de Médecine de l’Université de Tokyo, au Japon, publièrent leurs travaux en 1998. Ils avaient résolu le problème de pistage de NO en concevant des composés qui, en sa présence, deviennent fluorescents.
Ces composés sont des diaminofluorescéines, des colorants qui réagissent avec NO en émettant une lumière intense de couleur verte dont on peut mesurer l’intensité et la longueur d’onde ; ces deux grandeurs permettent la détermination de la quantité de NO présente. La réaction avec NO est très spécifique et il n’existe pas de signal parasite témoignant de la réaction des molécules de colorant avec d’autres substances des tissus biologiques. Le test est si sensible qu’il permet de détecter de très faibles concentrations de NO, de l’ordre de quelques anagrammes par litre, autrement dit, de parties par trillion (0,001 p.p.b.).
Docteur NO
L’utilisation de médicaments conduisant à la formation de NO remonte à plus de 125 années durant lesquelles ils ont sauvé un nombre incalculable de vies. L’histoire a commencé avec Antoine Jérôme Balard (1802-1876) qui recherchait les composantes responsables de l’altération de l’odeur de l’eau de Vie de Marc, le cognac distillé à partir de la pulpe de raisin pressé, une fois le vin fait. Il l’identifia comme étant le nitrite d’amyle et il remarqua qu’il provoquait chez lui de violents maux de tête. D’autres personnes qui étudièrent ce composé, inhalèrent ses vapeurs et remarquèrent qu’il provoquait une accélération du rythme cardiaque et une congestion du visage, cet effet ne durant qu’une minute environ.
Sir Benjamin Ward Richardson (1828-1896) a étudié les effets thérapeutiques du nitrite d’amyle et les a décrits dans sa conférence, en 1864, lors de la rencontre annuelle de l’Association Britannique pour la Promotion de la Science (British Association for the Avancement of Science). Cependant, c’est un autre médecin londonien, Sir Thomas Lauder Brunton (1844-1916) qui en a déduit que c’était un vasodilatateur. Sir Thomas l’a testé sur ses patients atteints d’angine de poitrine, lesquels en tirèrent de grands bienfaits. Il publia ses résultats dans la revue de médecine la plus importante, The Lancet, en 1867. Le reste appartient à l’histoire.
Le nitrite d’amyle est un liquide volatil qui bout à 98 °C. Les personnes qui risquent d’avoir une angine de poitrine pourraient se munir d’une petite capsule en verre contenant du nitrite d’amyle qu’ils casseraient dans un mouchoir pour en inhaler les vapeurs ; ils s’en verraient soulagés. Cela est mentionné dans le roman The Case of the Résident Patient {Le patient à demeure) dont le personnage principal est Sherlock Holmes.
Pendant ce temps, en Suède, dans la propre usine d’Alfred Nobel, il se passait quelque chose d’étrange. Alors que Nobel lui-même se plaignait d’élancements dans la tête lorsqu’il était à son travail, certains de ses employés, qui souffraient de troubles cardiaques et qui travaillaient à la fabrication et à la manutention de la nitroglycérine, voyaient leurs douleurs à la poitrine disparaître lorsqu’ils se trouvaient sur leur lieu de travail. Cette observation attira l’attention des médecins locaux qui en vinrent finalement à prescrire la nitroglycérine pour traiter les cardiopathies. Lorsqu’il fut malade, Nobel lui-même subit ce traitement en dépit de ses effets secondaires, des maux de tête. Dans une lettre qu’il écrivit à cette époque, il disait : « Quelle ironie de voir mon médecin me prescrire de manger de la nitroglycérine ». Le traitement consistait à placer une petite pilule de 0,5 mg de nitroglycérine sous la langue. Celle-ci se dissolvait rapidement dans le sang et apportait un soulagement en moins de deux minutes. (Ces comprimés ne présentaient aucun danger d’explosion car la nitroglycérine était mélangée à du lactose ou un autre glucide.)
Une exposition à la nitroglycérine pouvait provoquer des migraines comme celle dont souffrait Nobel. Les médecins l’appelaient le mal de tête de la nitroglycérine. C’était l’un des effets secondaires que connaissaient les travailleurs qui manipulaient la nitroglycérine, les autres se manifestant par une congestion du visage, des palpitations, des urines abondantes. Cette maladie était aussi appelée le mal de tête du lundi car elle affectait généralement les travailleurs le premier jour de la semaine mais elle s’atténuait à mesure que l’organisme s’adaptait à la nitroglycérine.
Durant la Première Guerre mondiale, les médecins avaient aussi remarqué les effets de la nitroglycérine chez les femmes qui participaient à son emballage : elles se plaignaient d’étourdissements et de vertiges. Un contrôle de leur tension artérielle mettait en évidence des tensions très basses qui étaient dues à la quantité de nitroglycérine inhalée et absorbée à travers leur peau. Durant la Seconde Guerre Mondiale, un autre explosif, le trinitrotoluène (TNT), généra les mêmes problèmes, et même quelquefois la mort, chez les personnes qui manipulaient les munitions.
De nos jours, la nitroglycérine se présente sous forme de spray (comme le Nat spray, par exemple) à vaporiser immédiatement sous la langue en cas d’attaque d’angine de poitrine ou juste avant un effort pouvant provoquer une attaque. On peut aussi l’appliquer directement sur la peau en utilisant un patch à 5 mg ou à 10 mg (Nitriderm TTS).
Toutes ces différentes formes de médicament contiennent un groupement N02 qui peut être lié au reste de la molécule soit par un des oxygènes (on parle alors de nitrite), soit par l’atome d’azote (on parle alors de composé nitré). Normalement, il ne serait pas souhaitable de traiter les patients avec NO directement car c’est un gaz toxique, comme l’a découvert à ses dépens, en 1800, le grand chimiste anglais Sir Humphry Davy (1778-1829) qui faillit en mourir. Pourtant, bien dosé, il peut sauver des vies.
Dans les années 1990, on utilisait le NO sous forme de gaz dans le cadre de la pratique clinique. Ainsi, pour soulager les congestions pulmonaires chez l’adulte et même chez le nourrisson, on en ajoutait de très faibles quantités (25 p.p.m.) à l’oxygène qu’ils respiraient. Environ 20 % des bébés libèrent un liquide visqueux, le méconium, qui passe de leurs intestins dans le liquide amniotique. Ce dernier peut obstruer les bronches et engendrer des difficultés respiratoires à la naissance. Le bébé qui était bleu à la naissance en raison d’un manque d’oxygène devient tout rose grâce à NO, et ce en un temps relativement court.
Pourtant, la meilleure façon d’accroître la quantité de NO dans notre organisme est de lui en fournir de manière indirecte et de diverses façons, sous forme de composés nitrés. Pour traiter les maladies cardiaques, on utilise notamment le tétra nitraté d’érythityle, le dénitrate d’isosorbide et le tétra nitrate de pentaérythritol qui sont tous des vasodilatateurs commercialisés sous des noms divers : ainsi, le tétra nitrate d’érythrityle est aussi connu sous les noms de Caldwell ou Nitrodex.
Ce produit agit lentement, en quinze minutes environ (bien que ses effets durent trois heures), ce qui explique pourquoi les patients lui préfèrent l’isosorbide dénitrate qui agit au bout de trois minutes mais dont les effets ne durent qu’une heure environ. Ce dernier est encore largement utilisé ; il est prescrit sous différents noms : Résorbant, Langoiran… Il se présente sous forme de comprimés, de comprimés à croquer ou de spray buccal. Enfin, le tétra nitrate de pentaérythritol agit après vingt minutes et ses effets durent six jours. Actuellement, ce dernier est rarement prescrit, bien que disponible sous forme de comprimés de Nitrodex. Tous ces vasodilatateurs sont métabolisés par des enzymes dans les cellules des muscles ou des vaisseaux sanguins pour libérer NO.
Comme la nitroglycérine, ce sont tous des explosifs puissants, cette propriété étant due aux nombreux groupements nitrates (N03) qu’ils contiennent. Lorsque le nitrate se décompose, il y a formation du gaz azote (N2) en même temps qu’un dégagement d’énergie. Parallèlement à cela, ses atomes d’oxygène se combinent aux atomes de carbone et d’hydrogène du reste de la molécule pour former du dioxyde de carbone et de l’eau, tout en libérant une plus grande énergie. Si vous heurtez violemment ces produits, l’onde de choc se propage dans le matériau, provoque des collisions entre nitrates, et en moins d’une
milliseconde, une réaction chimique s’amorce, devient une réaction en chaîne, et c’est l’explosion.
Plus nous en savons sur NO, plus nous pouvons expliquer d’autres observations. Par exemple, nous venons de découvrir que NO a protégé notre alimentation durant plus d’un siècle. Les producteurs de viande ont longtemps utilisé le nitrite de sodium afin d’empêcher de dangereuses bactéries de proliférer dans le jambon salé et dans les boîtes de corned-beef, alors que personne ne savait exactement pour¬quoi c’était si efficace. Maintenant, nous le savons : ce nitrite de sodium est un fournisseur de NO. Même après avoir mangé notre sandwich au corned-beef, NO est peut-être présent pour l’aider durant son cheminement (cette molécule déclenche les contractions du système digestif qui déplacent le bol alimentaire à travers l’estomac et les intestins). Le nitrite de sodium donne à la viande une couleur rouge et une apparence de fraîcheur. Cela est induit par sa réduction en NO qui se lie ensuite au fer de l’hémoglobine pour former un composé rose.
Les macrophages sont des cellules sanguines qui traquent les particu¬les étrangères telles que les bactéries envahissantes ou les cellules mutantes et les détruisent en leur injectant une dose mortelle de NO. Ce dernier forme une liaison avec des protéines appelées facteurs de transmissions qui activent et désactivent les gènes. Le NO lui-même se lie aux atomes de soufre des acides aminés de la protéine qui au bout d’un certain temps doivent être enlevés. Dans le même temps, l’orga¬nisme prépare son système immunitaire à lutter contre les microbes envahissants et à les tuer. Cependant, les bactéries ont leurs propres défenses, sous forme de protéines-leurre possédant des atomes de soufre qui peuvent même éliminer NO et elles ont même un facteur de transcription qui, lorsqu’il est lié à NO, réagit en activant un grand nombre de gènes pour fabriquer leurs propres protéines de défense.
On reconnaît maintenant que la formation d’une liaison entre NO et les atomes de soufre des protéines est l’un des plus importants mécanismes d’activation qui se déroule dans l’organisme. Les travaux de recherche de Jonathan Stamler de la Faculté de Médecine de l’Université (University Médical Center) de Duke en Caroline du Nord, États-Unis, ont contribué à découvrir la façon dont NO provo¬que ses effets. Nous savons maintenant que NO cible deux types d’atomes : les atomes de soufre des protéines et les atomes métalliques des molécules d’hème. C’est par le biais de ce deuxième type d’interaction qu’il agit sur la molécule messagère GMPc1, en moins d’une minute.
Si notre organisme produit un léger excès de NO, on observe une inflammation locale. Un des symptômes les plus irritants de la coque¬luche est la toux elle-même, provoquée par une surproduction de NO dans la trachée.
Pas de NO, pas de sexe
Les hommes ne sont pas les seuls à « allumer » les femmes pour révéler leur empressement à s’adonner au sexe. Les lucioles le font de manière permanente, et elles aussi comptent sur NO. En 2001, BarryTrimmer et ses collaborateurs de l Université Tufts, dans le Massachusetts ont décrit ce phénomène dans leurs travaux. NO est le messager chimique qui déclenche les cellules qui génèrent les éclats de lumière ; ces chercheurs ont montré que lorsqu’on plaçait ces insectes dans une atmosphère contenant 70 p.p.m. de NO, ils brillaient de façon permanente.
Chez les hommes, l’effet de NO est plutôt spectaculaire. Les stimuli érotiques du cerveau envoient un signal aux nerfs du corps caverneux, le muscle spongieux du pénis, qui libère alors de l’oxyde d’azote. Celui-ci relâche les muscles lisses du corps caverneux et permet au sang d’inonder les tissus qui gonflent et produisent une érection. Le premier article décrivant ce rôle de NO a été publié par le Professeur K.-E. Andersson au Centre Hospitalo-Universitaire (University Hospi- tal), de Lund en Suède, dans la revue Acta Physiologica Scandinavica. En fait, il avait été soumis pour publication après qu’un article similaire émanant d’un groupe de la faculté de médecine de Boston, dans le Massachusetts avait été soumis au Journal ofClinical Investigation, mais ce dernier parut après l’article d’Andersson. Comme vous pouvez l’imaginer, ce travail a attiré l’attention des médias internationaux, mais cela semblait dérisoire devant le battage médiatique qui a entouré la découverte de notre prochaine molécule.
Vidéo: Oxyde d’azote (NO)
Vidéo démonstrative pour tout savoir sur: Oxyde d’azote (NO)