L'atome de Rutherford : un mini système solaire
Ernest Rutherford tirera les conclusions des résultats de cette expérience dans un article publié en 1911. L’observation la plus surprenante, et donc la plus importante, est la troisième. Certaines particules sont renvoyées – on dit « diffusées » – vers l’arrière. Elles semblent « rebondir » sur la mince feuille de métal ! Par la simple application des principes de la mécanique (et, plus précisément, de la loi de conservation de la quantité de mouvement), Rutherford en conclut qu’elles ont rencontré un obstacle dont la masse est beaucoup plus importante que la leur. Il y a donc, au centre de l’atome, un « noyau » très massif. Manifestement, ce noyau repousse les particules a. Cela indique que sa charge électrique est la même que celle de ces projectiles, donc positive. Comme le nombre des particules diffusées est très faible, ce noyau doit être très petit par rapport aux dimensions de l’atome.
Les très nombreuses particules dont la direction est pratiquement inchangée n’ont rencontré que du vide, ou des obstacles de masse insignifiante. Quant à celles qui sont plus ou moins déviées, c’est qu’elles sont passées plus ou moins près du noyau de l’atome. Sur la base d’une interaction purement électrostatique entre les particules a et le noyau de l’atome-cible, Rutherford calcule les différentes trajectoires possibles et trouve qu’elles ont la forme dè branches d’hyperboles plus ou moins ouvertes.
La forme de ces hyperboles, et donc la distribution angulaire des particules a, doit varier selon la charge du noyau de l’atome. L’expérience de Marsden et Geiger,
répétée pour plusieurs feuilles de métaux différents, confirme ce résultat. La comparaison entre le calcul et l’expérience montre que la valeur à affecter à la charge (positive) du noyau, est égale et opposée à Z fois celle (négative) de l’électron, Z étant un nombre entier qui varie avec la nature chimique de la cible. De plus, la valeur de Z correspondant à chaque élément-cible n’est autre que son numéro atomique, c’est-à- dire le numéro de la case qu’il occupe dans le tableau de Mendeleïev. Ce résultat, qui sera brillamment confirmé, quelques années plus tard grâce aux études menées sur l’émission de rayons X par le physicien britannique Henry Moseley, donne toute sa signification à la classification du grand chimiste russe. C’était la masse atomique des éléments qui lui avait servi de guide, mais c’est leur nombre d’électrons (Z) qui correspond au numéro de chacune des cases.
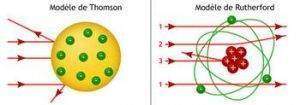
L’expérience de Marsden et Geiger et l’interprétation de Rutherford permettent donc de préciser l’image de l’atome. D’ores et déjà, le modèle de Thomson-Lorentz, qui implique une répartition « douce » des charges dans l’ensemble de son volume, a été rayé de la carte. Une telle répartition ne peut en aucun cas rendre compte de la diffusion des particules alpha vers l’arrière.
À l’inverse, l’atome de Rutherford est très inhomogène. Il possède un noyau, petit, central, massif et réunissant toute la charge positive (Z • e) de l’atome. Comme on sait que ce dernier est globalement neutre, et qu’il contient des électrons, ceux-ci doivent être périphériques, et leur nombre est égal à Z. De la même façon que le Soleil attire les planètes par la force de gravitation universelle, les électrons, chargés négativement sont retenus au sein de l’atome par l’attraction du noyau central. On remarque cependant que la force mise en jeu n’est pas gravitationnelle, mais électrostatique. Cependant, ces deux forces variant de façon identique avec la distance, l’atome se comporte comme un tout petit système solaire. À l’instar des planètes tournant autour du Soleil, les électrons « gravitent » autour du noyau selon des trajectoires qui peuvent être elliptiques ou circulaires.Un tel modèle avait été proposé dès 1901 par Jean Perrin, mais ce n’était alors qu’une hypothèse plausible. Après les résultats des expériences réalisées dans son laboratoire, Rutherford peut désormais l’asseoir sur de solides bases expérimentales.
1 réponses pour "L'atome de Rutherford : un mini système solaire"
POURQUOI LE DIAMETRE DU NOYAU EST TRES PETIT , COMPARE A L ATOME ENTIER ? selon rutherford ,
merci beaucoup
cordialement